Perguntas frequentes
-
-
1. Quem pode participar do Sandbox Regulatório da Anvisa?
A proposta em estudo prevê que o Sandbox Regulatório da Anvisa seja direcionado a pessoas jurídicas, incluindo empresas reguladas e startups que desenvolvam, produzam e/ou comercializem produtos ou serviços inovadores sujeitos à vigilância sanitária.
A seleção dos participantes ocorrerá por meio de Editais de Chamamento Público, que serão publicados e amplamente divulgados no Portal da Anvisa.
As propostas deverão atender aos critérios de elegibilidade definidos pela Agência e cumprir as condições específicas estabelecidas em cada edital.
Atualmente, está em fase de lançamento o primeiro Projeto-Piloto do Ambiente Regulatório Experimental (Sandbox Regulatório), voltado à avaliação de Produtos de Higiene Pessoal, Cosméticos e Perfumes Personalizados. Esse projeto servirá como base para a validação do modelo proposto para a Agência.
Confira as regras para participação no Projeto-Piloto aqui.
O Ambiente Regulatório Experimental em estudo na Anvisa está sendo desenvolvido de forma transversal, com potencial de aplicação em todas as áreas de atuação da Agência relacionadas à sua missão institucional de proteger e promover a saúde da população.
Neste momento, somente as propostas relacionadas ao tema do Projeto-Piloto poderão participar do processo seletivo. Novas candidaturas, voltadas a outros setores ou temáticas, deverão aguardar futuras chamadas públicas, que serão abertas de acordo com as prioridades e necessidades regulatórias identificadas pela Anvisa.
-
2. Quais são as etapas previstas para a realização do Sandbox Regulatório da Anvisa?
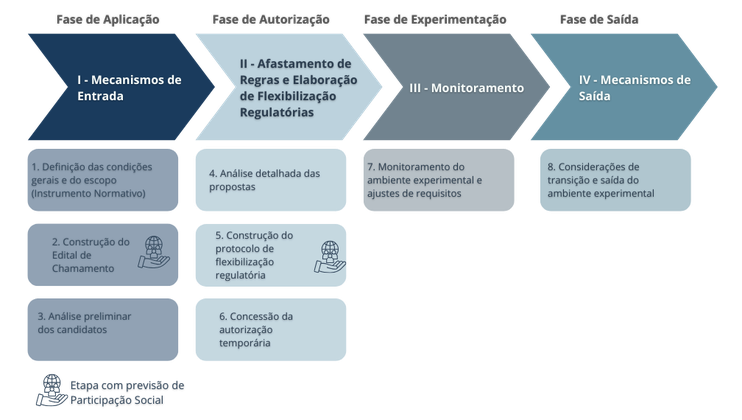
O fluxo do Ambiente Regulatório Experimental, atualmente testado no Projeto-Piloto do Sandbox Regulatório para Cosméticos Personalizados, no contexto da Análise de Impacto Regulatório (AIR) em desenvolvimento na Anvisa, está estruturado em quatro fases, cada uma associada a mecanismos específicos que orientam o processo:
- Fase de aplicação: reúne os mecanismos de entrada responsáveis por organizar a submissão e a seleção das propostas;
- Fase de autorização: compreende os mecanismos de afastamento de regras e a definição de critérios, limites e salvaguardas que formalizam as condições de participação;
- Fase de experimentação: engloba os mecanismos de monitoramento, voltados ao acompanhamento contínuo dos projetos; e
- Fase de saída: abrange os mecanismos de encerramento e transição, que consolidam os resultados e tratam da conclusão do experimento.
Fase de Aplicação
A fase de aplicação compreende a elaboração e publicação da minuta do Edital de Chamamento Público (Edital de Seleção), que é submetida à consulta pública para garantir transparência e participação social na definição das regras do ambiente experimental.
Após a consolidação das contribuições recebidas e a publicação da versão final do edital, inicia-se a submissão das propostas pelas pessoas jurídicas interessadas — empresas ou startups — marcando o começo efetivo do processo seletivo.
Nessa etapa, ocorre o recebimento da documentação preliminar que comprova o atendimento aos critérios gerais de elegibilidade definidos na RDC, incluindo evidências da capacidade jurídica e técnica da empresa, da adequação e inovação do produto ou serviço em relação ao escopo do edital e da viabilidade do projeto.
A análise preliminar, de caráter eliminatório e classificatório, atua como um checklist para verificar a conformidade das candidaturas com os critérios mínimos estabelecidos, permitindo identificar antecipadamente propostas que não atendem a todos os requisitos e assegurando que apenas aquelas em conformidade avancem para as etapas seguintes.
Fase de Autorização
A fase de autorização envolve a análise detalhada das propostas aprovadas na etapa preliminar. Nessa fase, são recebidas as documentações complementares dos candidatos pré-aprovados e realizada uma avaliação técnica aprofundada das propostas, com o objetivo de confirmar sua viabilidade.
Esse processo ocorre de forma iterativa e colaborativa, podendo contar com a participação dos proponentes, partes interessadas, afetadas e especialistas, conforme a natureza e a complexidade do tema.
Durante essa etapa, são definidas as regras que poderão ser flexibilizadas e elaborado o Protocolo de Flexibilização Regulatória Experimental, que estabelece critérios, limites e salvaguardas para garantir a execução segura, o monitoramento e a avaliação do ambiente experimental.
Quando aplicável, o protocolo será submetido à participação social, observando as restrições legais relacionadas ao sigilo industrial, comercial e à proteção de dados pessoais.
A fase se conclui com a concessão da autorização temporária, ato administrativo que formaliza todas as condições do experimento e autoriza o início das atividades no ambiente regulatório experimental.
Fase de Experimentação
Com a concessão da autorização temporária, inicia-se a execução do experimento.
Os mecanismos de monitoramento acompanham o cumprimento dos limites, condições e salvaguardas estabelecidos, permitindo antecipar riscos e adotar medidas mitigadoras sempre que necessário.São realizadas avaliações periódicas de resultados e indicadores, que geram evidências para subsidiar a continuidade do experimento ou a revisão de requisitos e procedimentos, conforme as necessidades identificadas.
Caso sejam constatadas infrações às condições estabelecidas, descumprimento das obrigações assumidas ou riscos não previstos e não passíveis de mitigação, a Anvisa poderá suspender ou cancelar a autorização temporária.
Essas medidas visam garantir a proteção da saúde, a segurança sanitária e a integridade do ambiente experimental.Fase de Saída
Após a conclusão do experimento, são tomadas as deliberações finais sobre a viabilidade e a continuidade do projeto, incluindo a concessão de licenças ou registros definitivos, quando aplicável.
Também é avaliada a necessidade de revisar normas cujas regras foram flexibilizadas durante os testes.Os mecanismos de saída contemplam medidas de transição, com destaque para a implementação do Plano de Descontinuidade das Atividades do ambiente experimental, que define as ações necessárias para encerrar o experimento de forma segura, transparente e proporcional aos riscos envolvidos.
Em situações justificadas, o modelo em estudo na Anvisa prevê a possibilidade de prorrogação excepcional da autorização temporária, por prazo limitado, quando a interrupção programada puder gerar riscos à saúde, prejuízos ao consumidor ou comprometer a consolidação dos resultados obtidos.
Nesses casos, a prorrogação deverá ser precedida de análise técnica da Anvisa e formalizada por meio de ato administrativo específico. -
3. Quem são os responsáveis pelo lançamento e acompanhamento dos Ambientes Experimentais na Anvisa?
Essa configuração busca promover a articulação entre as áreas envolvidas, garantir o alinhamento das análises e conduzir as iniciativas de forma eficiente, fortalecendo a capacidade da Anvisa de incentivar a inovação com segurança e qualidade regulatória.
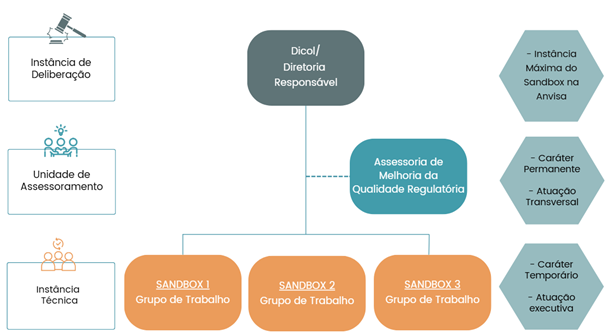
Instância Técnica
A Instância Técnica será composta por Grupos de Trabalho (GTs) criados para cada edital de seleção. Esses grupos, de caráter temporário e atuação executiva, serão formados pelas Unidades Organizacionais (UORGs) que compartilham responsabilidade sobre o tema do experimento.
A coordenação de cada GT ficará a cargo da UORG demandante, responsável por conduzir as atividades específicas relacionadas ao ambiente regulatório experimental.
Instância de Deliberação
As decisões finais relacionadas ao Sandbox Regulatório são de responsabilidade da Instância de Deliberação, que se baseia nas análises e recomendações da Instância Técnica. Dependendo da natureza da decisão, essa instância poderá ser representada pela Diretoria responsável pelo projeto ou pela Diretoria Colegiada (Dicol), conforme previsto na estrutura em teste.
Unidade de Assessoramento
A Coordenação de Análise de Impacto Regulatório (COAIR), vinculada à Assessoria de Melhoria da Qualidade Regulatória (ASREG), foi responsável pela definição do modelo transversal do Sandbox Regulatório da Anvisa e atuará como Unidade de Assessoramento em todos os ciclos experimentais, desde a concepção até a fase de saída do ambiente regulatório.
-
4. Como se dará o envolvimento das vigilâncias sanitárias estaduais e municipais no Sandbox Regulatório da Anvisa, considerando a estrutura descentralizada do SNVS?
O Sistema Nacional de Vigilância Sanitária (SNVS) integra instâncias da União, dos Estados, do Distrito Federal e dos Municípios, que atuam de forma coordenada para proteger a saúde da população. Nesse contexto, a participação das vigilâncias sanitárias estaduais e municipais (VISAs) é estratégica para o sucesso do Sandbox Regulatório da Anvisa.
O modelo em desenvolvimento prevê que esse envolvimento ocorra conforme as competências e atribuições de cada esfera federativa, variando de acordo com o risco sanitário das inovações, a abrangência geográfica e o escopo de cada projeto-piloto. Além disso, a Anvisa busca promover o intercâmbio de aprendizados e fortalecer o SNVS como um todo, estimulando integração, transparência e corresponsabilidade entre os entes federativos.
Assim, antes da implementação de qualquer proposta de sandbox regulatório em análise, as unidades do SNVS das jurisdições potencialmente envolvidas serão consultadas e convidadas a participar do desenvolvimento das atividades.
-
5. Que tipos de inovações poderão ser testadas no ambiente experimental da Anvisa?
Poderão ser testadas inovações que atendam aos critérios de elegibilidade definidos pela Anvisa e que enfrentem barreiras regulatórias que dificultem sua implementação no mercado. Essas inovações devem estar relacionadas a produtos ou serviços sujeitos à vigilância sanitária e se enquadrar no tema e escopo estabelecidos no Edital de Chamamento específico.
No momento, apenas propostas vinculadas ao tema deste edital poderão participar do processo seletivo. Novas candidaturas, voltadas a outros setores ou temáticas, deverão aguardar futuras chamadas públicas, que serão abertas conforme as prioridades e necessidades regulatórias identificadas pela Anvisa.
-
6. Quais são os critérios de elegibilidade para participação no Sandbox Regulatório da Anvisa?
Os critérios gerais de elegibilidade orientam a seleção das propostas que poderão participar dos ambientes regulatórios experimentais da Anvisa. Eles foram definidos com base em referências nacionais e internacionais e serão aplicados a todos os editais de chamamento público, observadas as especificidades de cada ciclo experimental.
Esses critérios estão agrupados em cinco categorias principais:

Os critérios específicos e as condições detalhadas de participação serão definidos em cada Edital de Chamamento Público.
-
7. Como funciona o processo de submissão, seleção de propostas e ingresso no ambiente experimental da Anvisa?
A seleção ocorre por meio de Editais de Chamamento Público, divulgados no Portal da Anvisa. Cada edital especificará o escopo, os critérios de seleção, os requisitos de participação, as etapas de avaliação e os prazos previstos.
As propostas deverão ser apresentadas dentro dos prazos e condições definidos em cada edital de chamamento público.
As submissões realizadas fora desses períodos não são analisadas pela Anvisa, uma vez que cada ciclo de seleção possui cronograma próprio e etapas específicas de avaliação.
O processo envolverá duas etapas de submissão documental:
- Documentação preliminar, apresentada na fase de aplicação, destinada à comprovação do atendimento aos critérios gerais de elegibilidade, incluindo a capacidade jurídica e técnica da empresa, a inovação e adequação do produto ou serviço ao escopo do edital e a viabilidade do projeto;
- Documentação complementar, apresentada na fase de autorização, após a aprovação preliminar, contendo os detalhes técnicos necessários para a elaboração do Protocolo de Flexibilização Regulatória Experimental.
As propostas passam por análises preliminar e detalhada, conduzidas pelos Grupos de Trabalho (GTs) da Anvisa, antes da concessão da autorização temporária.
Durante a análise detalhada, são verificadas a viabilidade técnica, a segurança, a maturidade do projeto e a aderência aos critérios definidos no edital. É importante destacar que a participação nessa etapa não garante a entrada no ambiente experimental.
As propostas podem ser desclassificadas nesta etapa caso não atendam integralmente aos requisitos técnicos e regulatórios ou não estejam contempladas dentro do número de vagas previsto no edital.
Quando o número de propostas elegíveis superar o limite de vagas disponíveis, será aplicado um critério de ranqueamento, que estabelece uma classificação das propostas com base em sua pontuação técnica, no mérito técnico-regulatório e na relevância para a saúde pública, conforme os parâmetros definidos no edital.
Para cada proposta aprovada, dentro do número de vagas previsto no edital, será elaborado, de forma individualizada, um Protocolo de Flexibilização Regulatória Experimental — documento que define as regras, limites e salvaguardas a serem observadas por cada participante durante o desenvolvimento do experimento.
Somente com a emissão da autorização temporária pela Anvisa, a empresa autorizada estará apta a ingressar no ambiente experimental e iniciar a execução das atividades previstas no protocolo.
-
8. Qual é o tempo de duração previsto para os testes realizados no Sandbox?
O prazo para a realização do experimento será concedido conforme as características e necessidades de cada proposta, sendo definido no Protocolo de Flexibilização Regulatória Experimental e formalizado na autorização temporária emitida pela Anvisa. A duração pode variar de acordo com a complexidade e o risco do projeto e poderá ser prorrogada, mediante nova avaliação pela Anvisa e decisão da instância de deliberação competente.
-
9. As condições e salvaguardas definidas poderão ser ajustadas durante o experimento?
Sim. Durante a fase de experimentação e monitoramento, a Anvisa poderá ajustar critérios, limites e salvaguardas, de forma motivada e proporcional, seja a pedido da empresa participante, seja em razão de necessidades identificadas pela própria Agência, sempre com o objetivo de preservar a segurança sanitária e garantir a confiabilidade dos resultados obtidos.
-
10. A Anvisa oferecerá acompanhamento técnico durante o desenvolvimento dos projetos?
Sim. Cada projeto selecionado será supervisionado por um Grupo de Trabalho (GT), composto por técnicos das áreas competentes. Esse grupo realiza o monitoramento contínuo do experimento por meio da avaliação dos relatórios trimestrais e finais apresentados pelas participantes, bem como de interações que podem incluir reuniões técnicas e visitas in loco. Além disso, o GT fornece orientações regulatórias ao longo de todo o processo, assegurando o cumprimento das condições estabelecidas e a integridade dos resultados obtidos.
-
11. Como a Anvisa garante a segurança sanitária durante os experimentos do Sandbox?
A segurança é o princípio central do modelo de Sandbox Regulatório.
Cada projeto passa por análise técnica detalhada, e o Protocolo de Flexibilização Regulatória Experimental define condições, limites e salvaguardas específicas para sua execução segura.
Além disso, os projetos são acompanhados por mecanismos de monitoramento contínuo, avaliações periódicas e planos obrigatórios de gestão de riscos e descontinuidade das atividades, assegurando que qualquer desvio ou impacto não previsto possa ser mitigado ou corrigido de forma imediata e controlada.
-
12. O que acontece se forem observados riscos não previstos durante o experimento?
Caso sejam identificados riscos que possam comprometer a segurança sanitária, o projeto poderá ser interrompido parcial ou totalmente, conforme a gravidade da situação.
Nesses casos, a empresa deverá executar imediatamente o Plano de Descontinuidade das Atividades, adotando medidas de contingência para mitigar impactos e proteger consumidores e usuários.
O encerramento do experimento poderá ocorrer de duas formas:
- Descontinuidade emergencial, quando há falhas inesperadas, problemas legais ou situações que exijam suspensão imediata.
- Descontinuidade planejada, quando o experimento é concluído conforme previsto no Protocolo de Flexibilização Regulatória Experimental.
-
13. O que acontece após o encerramento do ciclo de experimentação?
A Anvisa poderá decidir, com base em critérios técnicos e nas evidências geradas durante o experimento, pela continuidade, ajuste, incorporação ou encerramento do produto ou serviço avaliado, bem como pela revisão das normas vigentes que foram temporariamente afastadas.
Os produtos que obtiveram êxito na experimentação devem passar pela avaliação e autorização sanitária regulares, conforme as normas vigentes para sua categoria antes da sua entrada total no mercado.
-
14. Os produtos e serviços avaliados no ambiente experimental seguem o mesmo rigor técnico da Anvisa? O ambiente experimental substitui a regularização formal?
Os produtos, serviços e tecnologias avaliados no Sandbox mantêm o rigor técnico e sanitário exigido pela Anvisa.
As normas que não são flexibilizadas continuam sendo integralmente aplicadas, e aquelas que temporariamente afastadas recebem critérios e salvaguardas específicas, garantindo a segurança durante o experimento.
O ambiente experimental não substitui o processo de regularização formal.
Ao final de cada ciclo, os produtos devem passar pela avaliação e autorização sanitária regulares, conforme as normas vigentes para sua categoria.O ambiente experimental serve para gerar evidências e aprendizados adicionais que podem orientar e aperfeiçoar futuras decisões regulatórias, tornando a análise mais ágil e precisa — sem comprometer a excelência técnica das análises realizadas pela Anvisa.
-
15. Em quais momentos pode ocorrer a participação social no Sandbox Regulatório da Anvisa?
A participação social no Sandbox Regulatório ocorre em diferentes momentos dentro de cada ciclo experimental. Durante a fase de Diagnóstico e Concepção, podem ser realizadas consultas técnicas com partes afetadas, interessadas e especialistas, voltadas à coleta de informações para avaliar a viabilidade da abordagem experimental.
O segundo momento ocorre com a submissão da minuta do edital de chamamento à consulta dirigida, inaugurando a participação social formal e estrutura no processo.
Já na fase de autorização, a elaboração do Protocolo de Flexibilização Regulatória Experimental pode envolver iterações com proponentes, partes afetadas, interessadas e especialistas e, quando cabível, ser submetido à participação social ampla, observados os limites legais de sigilo industrial, comercial e de proteção de dados pessoais.
Esses mecanismos visam garantir que o Sandbox da Anvisa seja desenvolvido de forma transparente, colaborativa e alinhada ao interesse público.
-
16. Onde posso acessar informações, editais e resultados sobre o Sandbox Regulatório da Anvisa?
Todas as informações oficiais sobre o Sandbox Regulatório — incluindo editais de chamamento, resultados de seleção, relatórios e documentos técnicos — serão disponibilizadas nesta seção do Portal da Anvisa.
Cada ciclo experimental contará com um espaço próprio dentro da página, identificado por ícone ou link específico, onde serão reunidas as informações consolidadas sob responsabilidade do respectivo Grupo de Trabalho (GT).
A manutenção dos conteúdos institucionais e dos temas transversais do Sandbox Regulatório da Anvisa é de responsabilidade da Coordenação de Assessoramento em Análise de Impacto Regulatório (COAIR) da Assessoria de Melhoria da Qualidade Regulatória (ASREG).
-
17. Como o Sandbox se integra ao ciclo regulatório tradicional da Anvisa?
O Sandbox Regulatório é um instrumento complementar ao ciclo regulatório tradicional da Anvisa. Ele é aplicado quando são identificadas barreiras normativas que impedem o avanço das análises por vias convencionais.
Nessas situações, os estudos regulatórios tradicionais — geralmente Análises de Impacto Regulatório (AIR)— passam a constituir os estudos preliminares de Diagnóstico e Concepção do Sandbox Regulatório.
Ou seja, as análises realizadas dentro do ciclo tradicional formam a base técnica e jurídica para avaliar a viabilidade de uma abordagem experimental, como o Sandbox.Dessa forma, o Sandbox emerge de dentro do próprio ciclo regulatório, garantindo continuidade metodológica e integração institucional.
Os resultados obtidos nos ambientes experimentais retornam ao ciclo tradicional como evidências qualificadas, que subsidiam a revisão de normas, o aperfeiçoamento de procedimentos e o desenvolvimento de políticas regulatórias.
Assim, o Sandbox e o ciclo tradicional formam um processo contínuo e retroalimentado, no qual a experimentação regulatória fortalece a regulação baseada em evidências.
-
18. Como ocorre a fase de Diagnóstico e Concepção do Sandbox Regulatório da Anvisa?
A fase de Diagnóstico e Concepção ocorre antes do início do fluxo formal de 4 etapas do Sandbox Regulatório, servindo como etapa preparatória que conecta o ciclo regulatório tradicional à experimentação regulatória.
Ela é composta pelos estudos preliminares conduzidos pelas áreas técnicas, que identificam barreiras normativas e avaliam se o problema pode ser tratado por meio de abordagens ágeis ou experimentais.
Esses estudos podem incluir Análises de Impacto Regulatório (AIR) e outros instrumentos de avaliação utilizados pela Anvisa.
Quando constatam a impossibilidade de prosseguir pelas vias convencionais, a área técnica pode verificar a pertinência e a viabilidade do uso do Sandbox frente a alternativas possíveis.
Durante essa etapa, são conduzidas análises de riscos e análises jurídicas, que examinam a segurança, a legalidade e a finalidade pública da proposta, além de consultas a órgãos e entidades afetados, quando necessário, para assegurar coerência e convergência regulatória.
Confirmada a viabilidade técnica, jurídica e regulatória, a proposta passa a integrar o fluxo formal do Sandbox Regulatório, que se inicia com a elaboração do edital de chamamento público — etapa submetida a participação social estruturada e definição das condições do experimento.
-
19. O Sandbox muda as prioridades da Anvisa ou afeta o trabalho que já é feito?
Não. O Sandbox foi proposto para estimular a inovação de forma responsável, permitindo que novas soluções sejam testadas com segurança e sob supervisão da Anvisa. Seu propósito é gerar aprendizados que fortaleçam a regulação sanitária, ampliando o acesso da população a produtos e serviços inovadores com qualidade e segurança.
O modelo que está sendo testado para a Anvisa estruturou a utilização da ferramenta em ciclos temáticos e planejados, com entrada programada de projetos e escopos bem delimitados, o que evita sobrecarga das áreas técnicas.
Nesse sentido, os temas serão triados de forma criteriosa, com base na identificação de barreiras regulatórias, relevância sanitária e alinhamento às prioridades institucionais, assegurando que cada ciclo tenha aplicação justificada e fundamentada.
Dessa forma, o Sandbox não substitui nem interfere nas atividades essenciais da Anvisa — ele complementa e aprimora o trabalho regulatório tradicional, fortalecendo a capacidade da Anvisa de acompanhar as transformações tecnológicas e regulatórias, antecipar tendências e transformar aprendizado em melhoria regulatória, sempre com foco na segurança e na proteção da saúde da população.
-
20. O Sandbox pode afetar a concorrência nos setores regulados pela Anvisa?
O Sandbox pode, em alguns casos, gerar riscos concorrenciais, já que apenas um número limitado de empresas participa de cada ciclo experimental.
Para minimizar esse risco, a Anvisa adotará critérios técnicos e transparentes de seleção, priorizando projetos de interesse público, relevância sanitária e potencial de aprendizado regulatório.
As autorizações concedidas são temporárias e não substituem licenças ou registros definitivos após o encerramento do ciclo experimental.
Ao final, os aprendizados obtidos são utilizados para avaliar e aperfeiçoar os marcos regulatórios da categoria, permitindo que todo o setor regulado se beneficie das evidências geradas.
Assim, o Sandbox visa estimular a inovação sem comprometer a concorrência, fortalecendo a regulação sanitária e beneficiando a sociedade.
-
21. O Sandbox Regulatório da Anvisa terá interface com a incorporação de tecnologias pelo Sistema Único de Saúde (SUS) ou pela Saúde Suplementar?
O modelo de Sandbox em estudo na Anvisa possui um caráter transversal, voltado à avaliação de inovações promissoras em todas as áreas sob vigilância sanitária. Nem todos os projetos terão interface com a incorporação de tecnologias pelo SUS ou pela Saúde Suplementar.
Quando essa interação ocorrer, a Anvisa buscará alinhamento com as políticas e diretrizes conduzidas pelos órgãos competentes, de modo a assegurar coerência com as prioridades de saúde, públicas e suplementares.
Ao término do período experimental, os produtos e serviços avaliados deverão seguir as vias formais de regularização antes de sua disponibilização ao mercado, respeitando todos os ritos e procedimentos já estabelecidos para sua autorização e eventual incorporação.
O objetivo é que o Sandbox contribua para gerar evidências técnicas e fortalecer a base regulatória, promovendo inovação responsável e benefícios concretos para a sociedade, sempre em respeito às competências e atribuições de cada instância do sistema de saúde brasileiro.
-
1. Quem pode participar do Sandbox Regulatório da Anvisa?